INTRODUCCIÓN
En el siguiente contexto daré a conocer las teorías tales como de gas , muchas de las leyes que incluye esta teoría para mayor entendimiento y comprensión del tema , la idea de este trabajo es que de manera didáctica y no tan monótona se pueda aprender y tener idea de algo sobre el tema que vamos a ver a continuación
OBJETIVOS
- OBJETIVO GENERAL
-Conocer y profundizar en conceptos, formulas, leyes de estos.
- OBJETIVOS ESPECÍFICOS
-Reconocer cada formula y ley a partir de los recursos de este informe.
-Manejar y reforzar lo visto en clase.
MARCO TEÓRICO
Se conoce como gas al estado de agregación de la materia que no tiene forma ni volumen propio. Principalmente está compuesto por moléculas no unidas, expandidas y con poca fuerza de atracción entre sí que es lo que hace que no tengan forma y volumen definido, lo que ocurrirá es que este se expandirá y ocupará todo el volumen del recipiente que lo contiene.
Aunque generalmente al gas suele utilizárselo como sinónimo de vapor, esto solo ocurre con aquel gas que puede condensarse o presurizarse si se somete a una temperatura constante.
A diferencia de los sólidos que ostentan una forma bien definida y difícil de comprimir y de los líquidos que fluyen y fluyen, los gases se expanden libremente como bien decíamos más arriba y su densidad es muchísimo menor a la de los líquidos y sólidos.
PROPIEDADES DE LOS GASES
El gas no tiene volumen Propio: Presenta volumen igual al del recipiente donde se contiene.
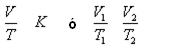
No posee forma propia: Asume la forma del recipiente donde lo coloquemos.
Tiene gran compresibilidad: Capacidad de reducción de volumen, como también de expansibilidad, esto es, capacidad de doblar de volumen dependiendo de la presión a la que está sometido.
* En la licuefacción de un gas existe contracción de volumen
* La vaporización se caracteriza por el aumento de volumen
El gas posee Variables: V (Volumen); P (Presión); T (Temperatura)
La Presión es medida en atmósferas (atm.) y también puede ser medida en mm de Hg (milímetros de mercurio). A nivel del mar, ella equivale a la columna de Hg de 760 mm de alto.
Temperatura
Existen varias escalas: las mas importantes como hemos mencionado en otros artículos son Celsius, Kelvin y Farenheit. La temperatura absoluta es la medida de una escala cuyo cero es el más absoluto (la más baja temperatura que existe equivale a cero grado en la escala Kelvin).
Volumen
Se utilizan las unidades usuales de volumen (L, dm3)
RELACIONES Y ECUACIONES RESPECTO A LA VARIABLE
- La relación entre Presión y Volumen Gaseoso
Un gas de masa fija, cuya temperatura es constante, tiene volumen inversamente proporcional a la presión del gas.
pV = K K = constante
- La relación entre el volumen gaseoso y temperatura
Existe una relación directamente proporcional entre el volumen de la masa, fija a presión constante y la temperatura absoluta del gas:
Transformaciones Isobáricas: Existe constancia de presión y cambios de temperatura y volumen.
- Relación entre Peso y Temperatura de un Gas
Entre la temperatura absoluta de un gas y la presión de su masa fija, la constante es también directamente proporcional.
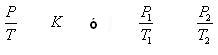
Cuando ocurren variaciones de presión y temperatura, pero existe constante de volumen, las transformaciones son llamadas isocóricas, isométricas o isovolumétricas.
Gas Ideal y Gas Real
A continuación el modelo teórico ilustrado debajo, exactamente como el de las leyes químicas. El gas ideal no existe realmente. Los gases reales, o existentes, se aproximan de esa exactitud matemática.
Gas ideal – Gas real – Transformaciones:

Ecuación General – Gases Ideales
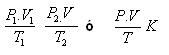
K = significa una constante
Gas en las condiciones normales – Temperatura y presión normales
Siglas usadas = C.N.T.P (condiciones normales de temperatura y presión)
Volumen normal
El mol en el gas ideal, cuando se aprecia C.N.T.P. (condiciones normales) tiene volumen = 22,4 litros en 1 mol de sustancia.
Ecuación
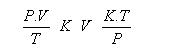
CONSTANTE UNIVERSAL DE LOS GASES
Es el caso en que el número de moléculas del gas es igual a un mol. Está representada por R. Cuando las condiciones de temperatura y de presión en gases cualesquiera son normales, existiendo también volúmenes iguales, el número de moléculas de ese volumen (V) es el mismo – en los gases ideales es aproximado a los gases reales. Esa es la Hipótesis de Avogadro.
Mezcla Gaseosa
Los gases son sometidos a presiones (presión corresponde a una variable de los gases). En las mezclas, cada gas sufre la presión como si estuviese solo – a esta condición se le da el nombre de presión parcial -. Ya la presión total de la mezcla gaseosa, representa la suma de las presiones parciales de los gases, principalmente de la mezcla.
Los gases en cuanto a la Densidad
Densidad Absoluta
Es el resultado de la división de la masa por el volumen. En el caso de la molécula, significa también la división entre masa y volumen.
Densidad Relativa
Se trata de un número puro, resultante de relaciones de la misma magnitud.
Las mezclas gaseosas – Características y Propiedades
Difusión
Fenómeno a través del cual los gases se mezclan de forma rápida y homogénea, formando un sistema monofásico. Cuando ocurre su salida a la atmósfera, ellos se esparcen, vale decir, se difunden.
Efusión
La efusión de los gases se da por el pasaje de los gases a través de pequeños orificios. La velocidad del fenómeno efusión (también válidos para la difusión) está dada por la Ley de Graham:
La velocidad de efusión o difusión se da en proporción de sus densidades
Densidad – Relación entre masas molares
Ecuación de la Ley de Graham o de la Velocidad
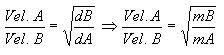
Leyes de los Gases
LEY DE BOYLE
Relación entre la presión y el volumen de un gas cuando la temperatura es constante
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
¿Por qué ocurre esto?
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
$$P \cdot V = k$$
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
$$P_1 \cdot V_1 = P_2 \cdot V_2$$
que es otra manera de expresar la ley de Boyle.
LEY DE CHARLES
La Ley de Charles es una ley de los gases que relaciona el volumen y la temperatura de una cierta cantidad de gas a presión constante.
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye
 |
| Representación esquemática de la Ley de Charles |
Ejemplos de Ley de Charles:
- Ejemplo 1: Calentamos una muestra de Hidrógeno (H2) a la presión constante de 1 atmósfera. Empezamos con 75 ml a 100ºK (-173ºC) y vamos subiendo de 100 en 100. Los valores del volumen obtenidos han sido:
- Estado 1: 100ºK y 75 ml → V/T = 0,75 = k
- Estado 2: 200ºK y 150 ml → V/T = 0,75 = k
- Estado 3: 300ºK y 225 ml → V/T = 0,75 = k
- Estado 4: 400ºK y 300 ml → V/T = 0,75 = k
- Estado 5: 500ºK y 375 ml → V/T = 0,75 = k
La ley de Gay-Lussac:
La Ley de Gay-Lussac es una ley de los gases que relaciona la presión y la temperatura a volumen constante.
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
- Si la temperatura aumenta la presión aumenta
- Si la temperatura disminuye la presión disminuye
 |
| Representación esquemática de la Ley de Gay-Lussac |
Ejemplos de Ley de Gay-Lussac:
- Ejemplo 1: Calentamos una muestra de aire a volumen constante. Empezamos en condiciones ambiente, es decir, presión de 1 atmósfera y temperatura de 22ºC (295ºK) y vamos subiendo de 100 en 100ºK. Los valores de presión obtenidos han sido:
- Estado 1: 295ºK y 1,00 atm → P/T = 0,00339 = k
- Estado 2: 395ºK y 1,34 atm → P/T = 0,00339 = k
- Estado 3: 495ºK y 1,68 atm → P/T = 0,00339 = k
- Estado 4: 595ºK y 2,02 atm → P/T = 0,00339 = k
- Estado 5: 695ºK y 2,36 atm → P/T = 0,00339 = k
 |
| resultados del experimento |
- Ejemplo 2: un gas ocupa un recipiente de 1,5 litros de volumen constante a 50ºC y 550 mmHg. ¿A qué temperatura en °C llegará el gas si aumenta la presión interna hasta 770 mmHg?
Solución: relacionamos temperatura con presión a volumen constante, por lo tanto aplicamos la Ley de Gay-Lussac: P1 / T1 = P2 / T2, donde:- T1 = 50ºC → 50 + 273 = 323ºK
- P1 = 550 mmHg
- P2 = 770 mmHg
- T2 = ?
Despejamos T2:- P1 / T1 = P2 / T2 → T2 = P2 / (P1 / T1 )
- T2 = 770/ (550 / 323) = 452,2 ºK
Ley General de los Gases:
La Ley General de los Gases consiste en la unión de las siguientes leyes:
- Ley de Boyle: P1 · V1 = P2 · V2
- Ley de Gay-Lussac: P1 / T1 = P2 / T2
- Ley de Charles: V1 / T1 = V2 / T2
Todas ellas se condensan en la siguiente fórmula que es aplicable para una misma cantidad de gas:
P1 · V1 / T1 = P2 · V2 / T2
donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en grados Kelvin)
Ejemplos de la Ley General de los Gases:
- Ejemplo 1: un gas tiene una presión de 600 mmHg, un volumen de 670 ml y una temperatura de 100ºC. Calcular su presión a 200ºC en un volumen de 1,5 litros.
Solución: tenemos masa constante de gas por lo que podemos aplicar la Ley General de los Gases: P1 · V1/ T1 = P2 · V2 / T2 , donde:Despejamos P2 :- P1 = 650 mmHg
- V1 = 670 ml = 0,67 litros
- T1 = 100ºC = 373ºK
- P2 = ?
- V2 = 1,5 litros
- T2 = 200ºC = 473ºK
- P2 = (P1 · V1 / T1 ) · (T2 / V2)
- P2 = (650 · 0,67 / 373) · (473 / 1,5) = 368 mmHg
PROCEDIMIENTO
Se accede a la siguiente pagina: http://www.educaplus.org/gases/index.html

Vamos al menú de esta pagina y observamos las opciones que nos da.








En la opción de conceptos tenemos:
En la opción de leyes observamos:
En la opción de Laboratorio encontramos actividades interactivas sobre estas leyes donde nos permite obtener la gráfica de los datos obtenidos:
- ACTIVIDADES:
Dentro de esta pagina encontramos ejercicios como los siguientes:
- LEY DE BOYLE
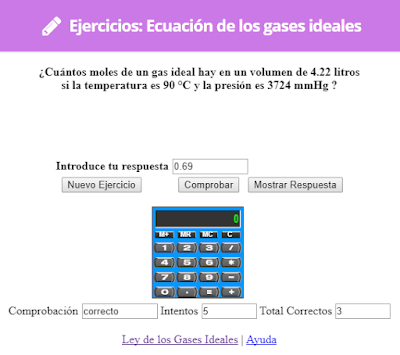
3. LEY DE LOS GASES IDEALES
- SOLUCIÓN DE ACTIVIDADES (LEY CHARLES)
WEBGRAFIA
- http://www.quimicas.net/2015/06/leyes-de-los-gases.html
- http://www.educaplus.org/gases/index.html
- https://es.wikipedia.org/wiki/Gas
- http://quimicades.blogspot.com.co/2011/05/gases-definicion-y-propiedades.html



























FALTÓ MÁS CONSULTA PARA MARCO TEÓRICO 4.5
ResponderEliminar